2023年5月5日,生命科学学院、泰康生命医学中心和免疫与代谢前沿科学中心陈学峰课题组在国际权威期刊Nucleic Acids Research上发表了题为“Proper RPA acetylation promotes accurate DNA replication and repair”的研究论文,武汉大学为第一作者单位。博士生甘晓丽为第一作者,陈学峰教授为通讯作者。研究生姜董豪、师敬尧、赵涵、谢成虞和王岩岩参与了该项研究。此外,该项研究得到了中国科技大学蔡刚教授团队、南京大学附属鼓楼医院许景艳教授、武汉大学张兴华教授、首都医科大学王海龙教授和浙江大学黄俊教授的支持。
DNA复制和修复过程中积累的错误会导致基因组不稳定和肿瘤发生。在肿瘤细胞中,常见源于不同DNA复制或修复蛋白功能丧失而导致的复杂的基因组重排和突变事件。因此,确保高保真的DNA复制和修复对于维持基因组稳定性和抑制人类疾病发生至关重要。复制蛋白A(RPA)在DNA复制和修复中发挥关键作用。RPA作为真核生物中主要的单链DNA(ssDNA)结合蛋白,参与所有的细胞核内重要DNA代谢过程,其功能异常会导致突变、染色体断裂、基因组不稳定甚至细胞死亡等严重后果。然而,在这些过程中,RPA是如何被精确调控以确保高保真的DNA复制和修复仍不清楚。
在该项研究中,作者首先以模式生物酿酒酵母为研究对象,利用遗传学、细胞生物学、生物化学等多种技术与方法,发现了动态RPA乙酰化和去乙酰化修饰调控DNA双链断裂(DNA double-strand breaks, DSBs)修复途径的选择,促进保真性较高的基因转换(Gene conversion, GC)或断裂诱导的复制(Break-induced replication, BIR),而抑制易错的可选择末端连接(Alternative end- joining, alt-EJ)或单链融合(Single-strand annealing, SSA)修复,揭示了RPA翻译后修饰在调控DNA修复中的新功能。同时,作者发现动态RPA乙酰化和去乙酰化修饰有助于抑制自发DNA突变,尤其是抑制微同源介导的多碱基缺失或插入事件,从而促进高保真的DNA复制。进一步研究发现,RPA乙酰化与RPA伴侣蛋白Rtt105在调控RPA功能中具有上位性效应,共同协作促进RPA入核,促进同源重组修复,而抑制自发突变和微同源介导的缺失或插入事件。在分子机制上,作者揭示了动态RPA乙酰化有利于促进RPA正常入核并有效结合ssDNA,同时还促进DNA修复蛋白Rad52和Rad51在DNA损伤处的募集,从而促进同源重组修复。
同时,利用多种DSB修复报告系统,作者发现在哺乳动物细胞中动态RPA乙酰化和去乙酰化修饰同样能够促进高保真的同源重组和BIR修复,而抑制易错的alt-EJ和SSA修复,暗示了这种调控机制的保守性。该项研究解析了RPA乙酰化修饰在维持基因组稳定性中的重要作用及分子机制,揭示了高保真DNA复制与修复的新调控机制,为理解肿瘤细胞中出现的部分特征性DNA突变提供了遗传学解释。
据悉,该项研究工作得到了国家重点研发计划项目、国家自然科学基金面上项目和武汉大学泰康生命医学中心的经费支持。
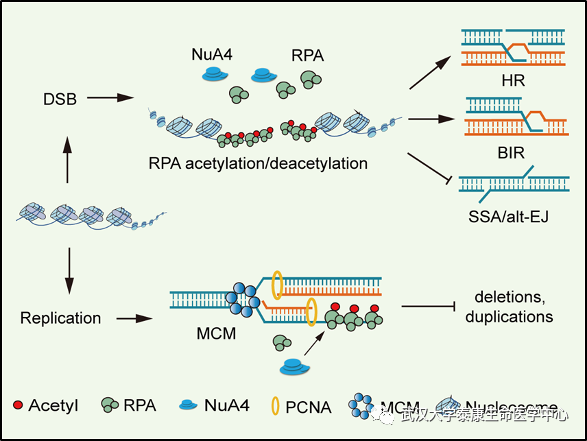
图:动态RPA乙酰化修饰促进高保真DNA复制与修复
论文链接:https://doi.org/10.1093/nar/gkad291