长期从食物中摄取过量胆固醇会加速动脉粥样硬化性心血管疾病的发生。虽然美国膳食指南取消了每天胆固醇摄入不超过300 mg的建议,但同时强调在营养充足的条件下,应该尽可能少的摄入胆固醇。Niemann-Pick C1-like 1(NPC1L1)对肠道胆固醇的吸收至关重要,并且是临床降脂药物依折麦布的作用靶点。NPC1L1与富含胆固醇和Flotillin阳性的膜微域一起通过网格蛋白介导的内吞作用内化并运输到内吞循环体(ERC)。当ERC胆固醇水平降低时,NPC1L1与LIMA1相互作用并返回质膜。然而,胆固醇如何离开ERC是未知的。
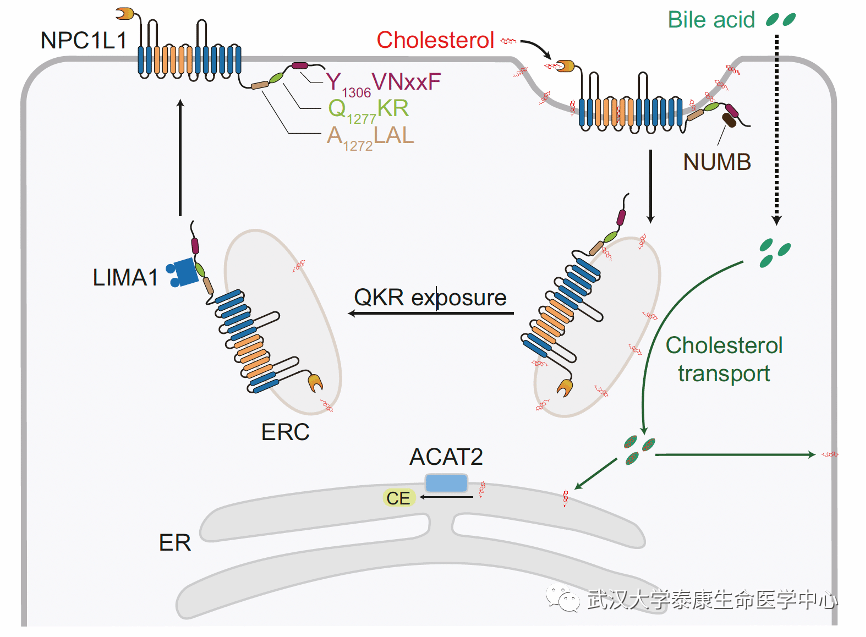
近日,武汉大学生命科学学院、泰康生命医学中心宋保亮院士团队在Nature Communications发表了题为Bile acids-mediated intracellular cholesterol transport promotes intestinal cholesterol absorption and NPC1L1 recycling的研究论文。该研究发现胆汁酸在细胞内以非胶束方式促进胆固醇从内吞循环体转运到其他细胞器,如内质网。当胆汁酸运出内吞循环体中的胆固醇时,先前通过A1272LAL序列与富含胆固醇的膜相互作用的NPC1L1羧基端从膜上解离,暴露其毗邻的Q1272KR序列;NPC1L1通过暴露后的Q1272KR序列通过招募LIMA1蛋白进一步运回质膜。本研究证明了胆汁酸的细胞内胆固醇转运功能,并阐述了在胆固醇吸收过程中,富含NPC1L1和胆固醇的内吞循环体上大量胆固醇是如何在小肠细胞中运出机制。

胆固醇是一种重要的脂质,可以调节细胞膜特性并共价修饰蛋白质,如 Hedgehog和Smoothened蛋白。高胆固醇水平是心血管疾病(CVD)和非酒精性脂肪肝疾病的关键危险因素。胆固醇可通过从头生物合成和膳食吸收获得。较高的膳食胆固醇摄入量与较高的心血管疾病风险显著相关。
Niemann-Pick C1 like 1 (NPC1L1)是一种13次跨膜蛋白,在小肠中参与饮食来源胆固醇的吸收。之前的研究表明,NPC1L1通过囊泡内吞作用吸收饮食来源胆固醇。NPC1L1的氨基端识别并结合胆固醇后,诱导其羧基端Y1306VNxxF (其中x代表任意氨基酸)暴露并结合NUMB。NUMB蛋白招募AP2/网格蛋白复合物后形成网格蛋白包被的囊泡进而启动NPC1L1内吞。通过这种囊泡运输方式,NPC1L1将大量胆固醇运输到内吞循环体 (ERC)。ERC通常用内吞的Rab11a蛋白作为它的标记物,同时由于ERC上富含胆固醇,因而它也被认为是细胞内重要的胆固醇库。当ERC中的胆固醇水平下降时,NPC1L1通过其Q1272KR残基结合LIMA1蛋白,并通过LIMA1和Myosin Vb复合物的帮助下返回到PM。LIMA1的失活突变导致细胞内NPC1L1滞留,降低肠道胆固醇吸收。依折麦布通过结合NPC1L1并抑制其内化来阻断胆固醇的吸收。
既往研究发现NPC1L1通过囊泡内吞作用摄取肠道胆固醇。内化的胆固醇和NPC1L1定位于与ER存在空间分离的ERC上。ERC胆固醇的减少促使NPC1L1返回到PM。
本研究中,研究人员发现胆汁酸(Bile acids, BAs),特别是CDCA, DCA, GDCA和TDCA,可以直接运输ERC中胆固醇。BAs介导的胆固醇扩散是无方向性的,它可以将ERC中胆固醇运输至ER以及PM。已知细胞内胆固醇运输主要通过囊泡转运和非囊泡转运的方式来转运,而BAs介导的胆固醇运输机制不属于上述两种已知的转运方式,它可能特异性地存在于小肠上皮细胞或肝细胞中。
既往研究表明,TDCA比TCA表现出更高的溶解能力。此外,TCA对脂/水界面具有较高的亲和力,有利于酶的吸附,而TDCA对界面具有较高的解吸能力,可以有效地去除界面上的水解产物。这些理化特性与研究人员的数据一致,TDCA (GDCA, DCA和CDCA)在体外和细胞中显示出比TCA更高的胆固醇运输能力。
据既往报道,在20名健康志愿者的胆汁中,GDCA和TDCA的百分比分别为<5% ~ >30%和<1% ~ >10%。在目前的研究工作中,研究人员发现在人类的12种主要BA物种中,有4种BA物种(CDCA, DCA, GDCA和TDCA)可以高效地将胆固醇转运出ERC。因此,BA的多样性可能是决定个体胆固醇吸收效率的另一个重要原因。
通过以上研究,该文还详细地归纳了NPC1L1介导饮食胆固醇吸收的整个过程。未进食胆固醇状态下,NPC1L1位于小肠刷状缘上,而羧基末端的Y1306VNxxF序列结合在PM上。进食胆固醇后,胆固醇与BAs在肠腔中充分溶解并以胶束(micelles)的形式向定位在刷状缘上的NPC1L1提供胆固醇。NPC1L1结合并内吞胆固醇至内吞循环体后,小肠吸收细胞中的BAs运出ERC中胆固醇至ER。在ER上,小肠吸收细胞表达的ACAT2蛋白将胆固醇转化成胆固醇酯,并进一步装载至乳糜微粒中。ERC中胆固醇运出后,其膜上胆固醇浓度降低并导致NPC1L1的羧基端A1272LAL氨基酸和膜的相互作用减少,进而暴露出其毗邻的氨基酸Q1272KR;NPC1L1通过Q1272KR招募LIMA1,在LIMA1的帮助下通过Myosin Vb沿着细胞骨架返回PM。
NPC1L1以胆固醇依赖性方式与膜结合
综上所述,这些结果表明,胆汁酸可直接运出内吞循环体上的胆固醇,导致NPC1L1蛋白中的A1272LAL残基从内吞循环体膜上分离,这进一步允许Q1272KR与LIMA1蛋白结合,然后NPC1L1被运输到细胞质膜。
武汉大学生命科学学院博士后肖健、博士生董乐薇为论文的共同第一作者,生命科学学院、泰康生命医学中心宋保亮院士为论文的通讯作者。
原文链接:https://www.nature.com/articles/s41467-023-42179-5#Sec10