胆固醇是调控膜功能的重要脂类分子,作为高度疏水的小分子,胆固醇如何在细胞内精准运输是长期未回答的重要科学问题。
2024年3月1日,细胞生物学领域著名期刊Journal of Cell Biology刊发了武汉大学高等研究院、生命科学学院、泰康生命医学中心宋保亮院士,生命科学学院、泰康生命医学中心罗婕教授和生命科学学院殷雷教授合作的最新研究论文,题为“Fatty acid-binding proteins 3, 7, and 8 bind cholesterol and facilitate its egress from lysosomes”(《脂肪酸结合蛋白3, 7, 8结合胆固醇并协助胆固醇运出溶酶体》)。该工作揭示了脂肪酸结合蛋白家族是一类新的甾醇转运蛋白,解析了FABP7介导低密度脂蛋白来源的胆固醇在细胞内运输的分子与结构机制,证明了同家族成员FABP3和FABP8也参与胆固醇从溶酶体的输出,并能在体外转运胆固醇类似物。
FABP7是从宋保亮院士团队前期在“溶酶体—过氧化物酶体膜接触介导胆固醇运输”(Chu et al., Cell 2015)的研究中发现的。它对n-3和n-9多不饱和脂肪酸具有高亲和力,并且能够促进二十二碳六烯酸、二十碳五烯酸和油酸的转运。FABP7及其家族成员FABP3和FABP8能结合并转运胆固醇属首次报道。FABP7缺陷会导致低密度脂蛋白来源的胆固醇在溶酶体中大量堆积,并降低质膜胆固醇水平(图1)。
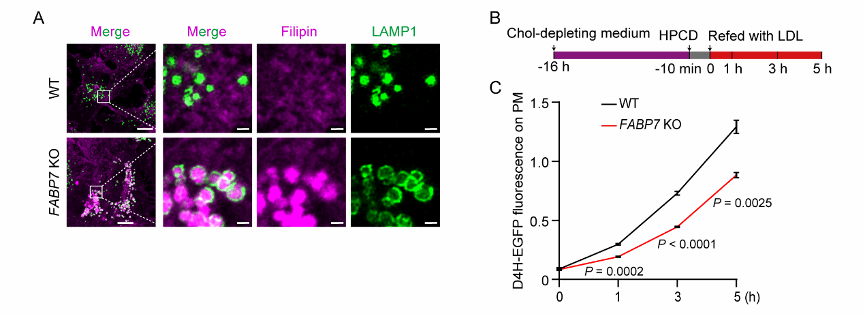
图1. FABP7缺陷阻碍胆固醇从溶酶体向质膜运输
结构分析显示,FABP7具有一个疏水性口袋,能将胆固醇包裹于其中(图2),帮助其在胞质水相中运输。体外结合实验表明,胆固醇与油酸等脂肪酸能竞争性结合FABP7;体外运输实验证明FABP3,7和8能在人工脂质体之间有效地转运胆固醇类似物脱氢麦角固醇。
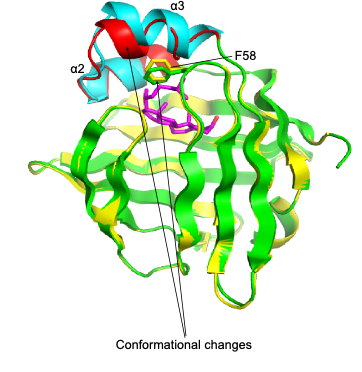
图2. FABP7结合胆固醇的晶体结构解析
该工作是宋保亮院士团队继发现溶酶体—过氧化物酶体—内质网膜接触这一全新胆固醇运输途径(Chu et al., Cell 2015; Xiao et al., Sci China Life Sci 2019; 分别入选“2015年中国生命科学十大进展”与“第八届中国科协优秀科技论文”)之后的又一重要进展。武汉大学高等研究院的博士生方贤秀和生命科学学院博士生魏鹏程为本论文共同第一作者,宋保亮教授、殷雷教授和罗婕教授为共同通讯作者。该研究的其它作者还包括武汉大学生科院博士生赵凯和盛召辰。该研究工作得到了基金委创新群体、基金委重大研究计划、湖北省自然科学基金的资助。
全文链接:https://rupress.org/jcb/article/223/4/e202211062/276590/