近日生命均会面对食物的短缺与环境温度的变化等,因此当食物充足时将过剩的能量进行有效的储存对生存繁衍至关重要。甘油三酯(脂肪)是能量运输与储存的重要形式,但是循环系统中甘油三酯不能被组织细胞直接吸收,需要借助于定位在毛细血管腔壁的甘油三酯水解酶LPL催化水解,以游离脂肪酸的形式进入细胞。上世纪50年代人们就发现进食增加白色脂肪组织的LPL活性,抑制心脏、肌肉、棕色脂肪组织等能量消耗器官的LPL活性,促进血液甘油三酯被白色脂肪组织吸收储存。饥饿逆转上述过程,促进血液甘油三酯被消耗器官吸收利用。武汉大学王琰课题组前期工作系统揭示了ANGPTL3、4、8在机体响应进食、运动等环境信号,调节组织特异性LPL活性与甘油三酯吸收利用中的核心功能(PNAS, 2012, 2013, 2015, JLR, 2015, JCI insight, 2024)。
米色脂肪细胞(Beige or brite adipocytes)是近年来发现的一类新的脂肪细胞,广泛存在于不同部位的白色脂肪组织,如小鼠的皮下脂肪等。在低温等条件下这些米色脂肪细胞可被诱导成具有产热功能的棕色化脂肪细胞,因其在抵抗肥胖与相关疾病中的潜在意义受到广泛关注。经典的白色脂肪组织与棕色脂肪组织分别代表了能量储存器官与能量消耗器官。进食增加白色脂肪组织LPL活性与甘油三酯吸收,而抑制棕色脂肪组织的LPL活性与甘油三酯吸收。进食如何调节 “米色脂肪组织”的LPL活性与甘油三酯吸收,尤其是棕色化过程如何重塑其LPL活性调节以适应其生理功能转变尚不清楚。
近日,武汉大学生命科学学院、泰康生命医学中心PI王琰课题组在Life Metabolism期刊上发表题为“Chronic cold exposure reprograms feeding-regulated LPL activity in white adipose tissues through hepatic ANGPTL3 and ANGPTL8”的研究论文。该研究发现长期低温在诱导白色脂肪组织棕色化过程中会逆转进食对其组织LPL的活性调节,并进一步揭示肝脏胰岛素信号通路以及肝脏分泌因子ANGPTL3与ANGPTL8在这一过程中的关键作用,对理解寒冷等环境因素重塑机体能量代谢稳态、尤其是白色脂肪组织棕色化过程中的代谢重塑机制提供新的思路。
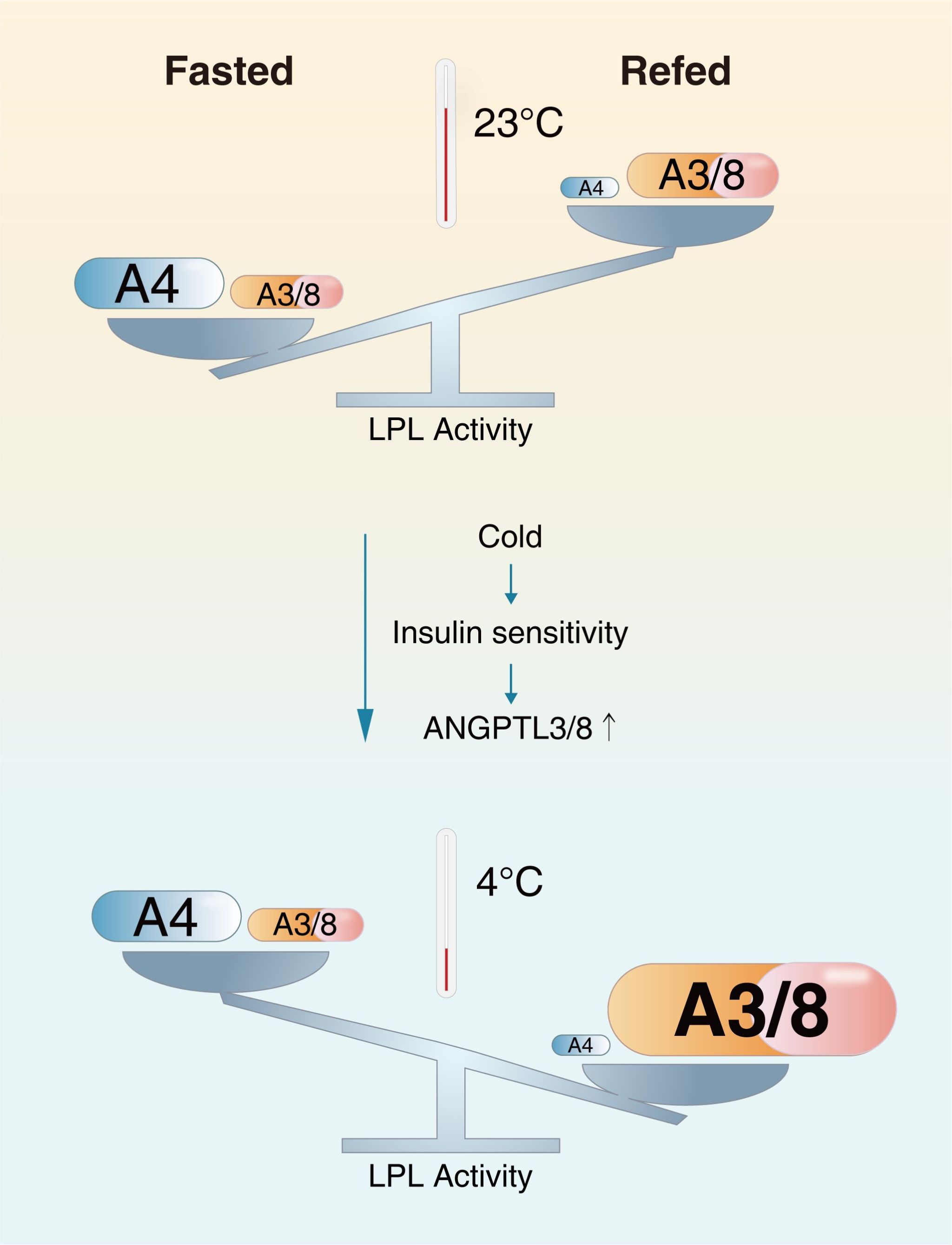
低温诱导前后白色脂肪组织LPL活性与甘油三酯吸收调节示意图
武汉大学生命科学学院博士生张宜粱为论文第一作者,王琰教授为唯一通讯作者。该课题受到科技部重点研发计划,国家自然科学基金委重大研究计划重点项目与武汉大学泰康生命医学中心的经费支持。
王琰教授课题组长期从事人类遗传学与脂质代谢研究,主要关注于人群中遗传突变导致脂代谢异常的发病机制,先后发现并揭示了PCSK9, GPR146, ANGPTL家族成员遗传突变导致血脂异常的发病机制,并深入揭示其调节脂质代谢的生理功能。针对PCSK9和ANGPTL3的抑制剂已成为新一代降胆固醇药物。王琰教授实验室长期招聘博士后(武汉大学推出“弘毅博士后”计划,支持条件优厚),欢迎对脂质代谢研究感兴趣的同学与王琰教授联系(Wang.y@whu.edu.cn)。
论文全文链接:https://doi.org/10.1093/lifemeta/loae037