2022年8月26日,武汉大学医学研究院、免疫与代谢前沿科学中心、中南医院及泰康生命医学中心宋威课题组在Immunity杂志上发表题为Renal NF-κB activation impairs uric acid homeostasis to promote tumor-associated mortality independent of organ wasting(肾脏NF-κB活化通过破坏尿酸代谢来增加肿瘤相关死亡率,且不依赖于器官消耗)的研究论文。
该研究通过在果蝇肠道中过表达活化的转录因子yki3SA(人体YAP1同源物),诱导肠道干细胞过度增殖形成肠道恶性肿瘤,进而造成机体消耗和寿命缩短。利用该模型,研究人员发现yki3SA肠道肿瘤可特异抑制肠道中肽聚糖识别蛋白PGRP-SC2的合成、造成机体细菌过度增殖和系统性IMD-NF-κB免疫信号的过度活化,从而导致果蝇死亡,但不影响机体能量消耗,首次表明荷瘤机体的消耗和存活率可以相互剥离。此外,他们进一步发现果蝇马氏管(Malpighian tubules,果蝇的肾小管组织)中IMD-NF-κB免疫信号活化导致尿酸(Uric acid)堆积是造成yki3SA荷瘤果蝇死亡的关键因素。

癌症恶液质(cancer cachexia)或肿瘤诱导的宿主消耗(host wasting)是一种系统性的代谢综合症,伴随着体重降低(包括脂肪和肌肉的流失)、高血糖和高死亡率,直接导致至少20%癌症病人的死亡。因其发病机理不明,目前全球缺乏有效的治疗手段,因此癌症恶液质也被评为“人类最后的疾病”。通过小鼠和大鼠肿瘤模型,研究人员逐步发现恶性肿瘤可通过分泌蛋白,如IL-6、TNF-a、Activin A、LIF、PTHrP等,直接促进宿主消耗。然而这些研究通常在无特定病原微生物条件下完成,因此忽视了环境中微生物以及宿主免疫反应的作用。
作为进化上保守的模式生物,果蝇近年来成为研究肿瘤诱导宿主消耗的理想模型。通过在果蝇体内诱导恶性肿瘤或者移植外源肿瘤,可完整的模拟癌症恶液质的表型,如脂肪流失,肌肉和卵巢萎缩,高血糖以及高死亡率等。利用果蝇恶液质模型,研究人员鉴定了一系列肿瘤分泌蛋白,如ImpL2、Pvf1、Upd3、Gbb等,分别通过insulin、MEK、Jak/Stat和TGFb信号通路来远程破坏宿主器官代谢平衡,造成宿主消耗。与小鼠模型不同,果蝇直接与外界空气和微生物直接接触,因此在肿瘤存在的背景下,果蝇成为一个研究宿主-微生物相互作用十分理想的工具。
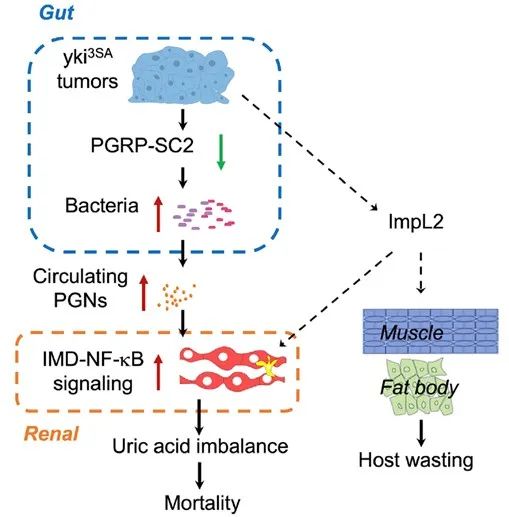
图1.yki3SA荷瘤果蝇中IMD-NF-κB免疫通路和分泌蛋白ImpL2调控宿主死亡和消耗的模式图
在该研究中,研究人员首先发现yki3SA肠道肿瘤果蝇体内细菌和真菌与对照组相比增加了500多倍,同时呈现出系统免疫的过度活化,主要是介导革兰氏阴性细菌免疫应答的IMD-NF-κB,而非Toll-NF-κB信号活化。利用抗生素处理和无菌果蝇的方法,抑制yki3SA果蝇体内细菌增殖和系统IMD-NF-κB活化,在不影响肿瘤生长以及器官和能量消耗的情况下,延长荷瘤果蝇的寿命。通过转录组分析和遗传操作发现,yki3SA肿瘤通过抑制肠道PGRP-SC2(在本研究中被鉴定为一种全新的具有广谱抗菌功能的分泌型酰胺酶)的合成导致肠道细菌过度增殖和系统性IMD-NF-κB活化,回复肠道PGRP-SC2表达则在不影响肠道肿瘤的前提下抑制细菌增殖和IMD-NF-κB活化、延长果蝇寿命。
研究者进一步挖掘组织特异性的IMD-NF-κB活化和死亡率的关系,通过GAL4/UAS和LexA/LexAop双基因表达系统,实现了在yki3SA肿瘤背景下阻断不同组织器官的IMD-NF-κB信号。他们发现只有抑制yki3SA果蝇马氏管中的IMD-NF-κB通路,而不是传统认为的肌肉、脂肪和大脑组织,可以有效缓yki3SA荷瘤果蝇的死亡率。结合转录组学、代谢组学和单细胞测序分析,他们发现yki3SA荷瘤果蝇的马氏管中IMD-NF-κB活化可以造成尿酸堆积、促进机体死亡;喂食别嘌呤醇(Allopurinol)抑制尿酸合成或在马氏管中特异阻断IMD-NF-κB通路可有效缓解yki3SA荷瘤果蝇的尿酸堆积,并延长寿命。之前课题组发现一种重要的肿瘤分泌蛋白ImpL2,也可以部分通过肾脏尿酸代谢导致机体死亡(图1)。重要的是,大规模的人群队列研究也发现高血尿酸(>400 mM)是多种癌症患者死亡率的重要独立风险因子。 总之,该研究发现环境微生物、肠道细菌、肾脏IMD-NF-κB免疫反应和尿酸代谢是恶性肿瘤导致机体死亡的重要因素,且独立于目前已知的肿瘤相关的机体消耗,为深入理解肿瘤-宿主互作、实现荷瘤生存提供了新的角度。鉴于生物体在自然界中不可避免地接触外在环境,因此外界微生物、肠道菌群、肾脏免疫反应和尿酸代谢实属 “房间里的大象”(图2),会在肿瘤以及其他疾病发生发展中发挥重要的作用。

图2.外源微生物、机体免疫反应和尿酸代谢是癌症恶液质研究中“房间里的大象”
武汉大学医学研究院、免疫与代谢前沿科学中心的博士生陈羽臣为本文第一作者,宋威教授为通讯作者。宋威课题组长期从事器官交流与免疫代谢调控的研究,主要集中在分泌蛋白介导肠道/肠道肿瘤远程调控机体重要器官的免疫与代谢平衡,其成果先后发表在Immunity、Cell Metabolism、Developmental Cell、PNAS等杂志上,为糖尿病、肥胖和癌症恶液质的发病机理提出了新的假说。现因发展需要,长期诚聘博士后,有意者请将个人简历和推荐信等材料发送至:songw@whu.edu.cn。
全文链接:https://doi.org/10.1016/j.immuni.2022.07.022