2022年9月19日,武汉大学生命科学学院、泰康生命医学中心刘勇课题组在Nature Metabolism杂志在线发表了题为“Adipocyte IRE1α promotes PGC1α mRNA decay and restrains adaptive thermogenesis”的研究论文,揭示了在脂肪细胞中IRE1α通过抑制米色脂肪细胞的活性,从而阻遏机体的适应性产热,在营养过剩条件下促进肥胖和糖脂代谢紊乱的发生发展。

在真核细胞中,当内质网难以承担未折叠蛋白负荷或代谢发生异常时会导致内质网应激(ER Stress),激活三条经典的未折叠蛋白响应(Unfolded Protein Response, UPR)通路,其中包括进化上高度保守的内质网应激感应蛋白IRE1通路。IRE1α是定位于内质网的跨膜蛋白,兼具有蛋白激酶活性与核糖核酸内切酶活性。在内质网应激条件下,IRE1蛋白发生寡聚化并通过自身磷酸化激活其核糖核酸内切酶活性,通过催化XBP1转录因子mRNA的非常规剪接产生具备活性的转录因子 XBP1 (XBP1s),从而驱动一个主要的UPR基因表达程序;同时,通过mRNA降解(Regulated IRE1-dependent mRNA decay, RIDD)下调特定的基因表达水平,缓解胞内内质网应激状况。在哺乳动物中,IRE1α能够在不同代谢组织细胞中感应机体的营养代谢状况,参与调节多种糖脂代谢过程。在营养过剩引发的肥胖过程中,脂肪组织会发生明显的代谢性重塑,伴随着显著的内质网应激反应。然而,在脂肪细胞中IRE1α信号通路是否及如何促进脂肪组织的功能异常目前依然模糊不清。
大量研究表明,脂肪组织产热功能障碍与肥胖的发生发展密切相关。为了深入剖析内质网应激与脂肪组织产热功能障碍之间的机制关联,研究人员通过动物模型发现,皮下白色脂肪和棕色组织中IRE1α通路在冷刺激后被显著激活,表明IRE1α蛋白可能参与调节脂肪组织的产热性重塑。通过构建脂肪细胞中IRE1α特异性敲除小鼠(AKO)模型,研究人员发现在冷刺激下AKO小鼠具有更强的体温维持能力即产热水平,其皮下腹股沟白色脂肪组织的棕色化程度也明显增强。此外,在肾上腺素受体激动剂处理后AKO小鼠具有更高的机体代谢速率,皮下脂肪组织的棕色化及脂解速率也显著升高。进一步的体外研究结果显示,IRE1α蛋白缺失的米色脂肪细胞具有更高的UCP1蛋白表达水平、线粒体活性和脂质氧化能力。为了解析IRE1α调节脂肪组织棕色化的分子机制,研究人员利用转录组学等生物学技术检测发现,IRE1α通过其RIDD机制下调转录共激活因子PGC1α的表达水平,进而抑制相关产热基因的表达程序。研究人员随后利用高脂诱导的肥胖小鼠模型发现,高脂饮食能够明显激活脂肪细胞中IRE1α的核糖核酸内切酶活性,同时显著下调PGC1α的表达水平,提示IRE1α-PGC1α通路可能在营养过剩导致产热脂肪发生功能异常的过程中具有重要的促进作用。进一步的代谢表型研究显示,AKO小鼠能够抵御高脂饮食诱导的肥胖及糖脂代谢紊乱,而且IRE1α核糖核酸内切酶的小分子抑制剂也能显著缓解高脂诱导的肥胖进程,改善肥胖小鼠的葡萄糖代谢功能。这些结果表明,脂肪细胞中的IRE1α核糖核酸内切酶是治疗肥胖及相关代谢疾病的潜在干预靶点。
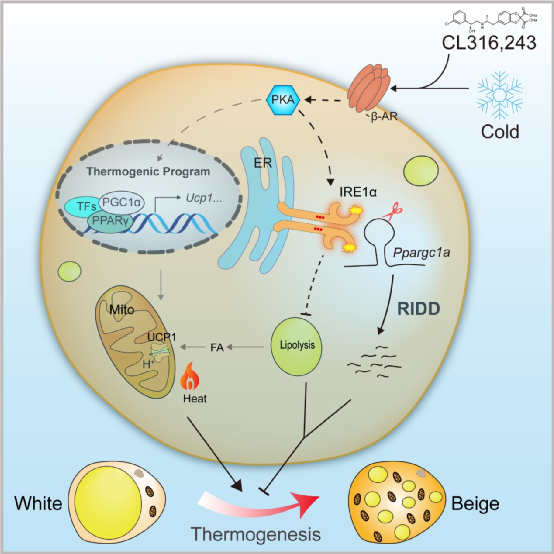
综上所述,此项研究结果证实了脂肪细胞中IRE1α在脂肪组织代谢重塑中的重要功能,揭示了IRE1α-PGC1α信号轴对米色脂肪细胞活化的负反馈调控作用,为靶向IRE1α核酸内切酶活性抑制肥胖及相关代谢性疾病提供了进一步的理论支持。
该项研究得到国家自然科学基金委重大项目和科技部重点研发计划等基金的资助支持,也得到中科院巴斯德研究所邵孟乐教授等国内外合作人员的大力协助。武汉大学生命科学学院博士研究生陈勇和吴著寅为共同第一作者,刘勇教授为通讯作者。
全文链接:https://www.nature.com/articles/s42255-022-00631-8