2022年9月15日,武汉大学生命科学学院/病毒学国家重点实验室、武汉大学泰康生命医学中心陈明周课题组在PLoS Pathogens杂志在线发表了题为“Vimentin inhibits α-tubulin acetylation via enhancing α-TAT1 degradation to suppress the replication of human parainfluenza virus type 3”的最新研究成果,该研究首次揭示了VIM蛋白抑制HPIV3复制的分子机制,并鉴定到一段来源于VIM蛋白的抗病毒多肽,为抗HPIV3药物研发提供了新的思路。

人副流感病毒三型(Human parainfluenza virus type 3,HPIV3)是副粘病毒科(Parainfluenza)典型致病病毒,是最常见的婴幼儿呼吸道病毒之一。HPIV3感染可导致婴幼儿上呼吸道和下呼吸道感染,严重的可致死亡,给家庭和社会带来很大损失,但至今无无疫苗及药物上市。因此,揭示HPIV3病毒的复制机制,并寻找相关抗病毒宿主蛋白的研究具有重大意义。HPIV3所形成的包涵体是病毒RNA合成的重要场所,而N-P复合物是组成包涵体的重要复合物。陈明周教授课题组通过利用免疫共沉淀技术,筛选到大量与N-P复合物相互作用的宿主蛋白,并从中鉴别到宿主蛋白VIM,发现该蛋白可以抑制病毒复制以及病毒包涵体的形成。
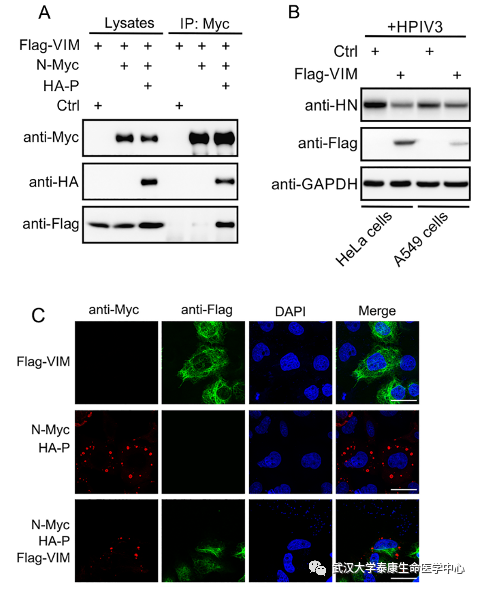
图一、VIM蛋白抑制HPIV3的复制与包涵体形成A、免疫共沉淀揭示VIM蛋白与N-P复合物具有相互作用B、 蛋白水平显示VIM蛋白抑制HPIV3的复制C、免疫荧光显示VIM蛋白抑制HPIV3包涵体的形成
随后的研究揭示,VIM蛋白可以通过其N端的Head区域结合N-P复合物和微管乙酰转移酶α-TAT1,并且抑制N-P复合物与α-TAT1的互作,促进α-TAT1降解,这导致微管乙酰化水平降低,从而抑制病毒复制结构形成和病毒RNA合成效果。更进一步地,确定了VIM的N端61-80位的氨基酸残基,是介导VIM与N-P复合物互作的关键区域,而来自该区域的多肽,对HPIV3的复制具有明显抑制效果。 综上所述,此项研究发现VIM蛋白通过促进微管乙酰转移酶α-TAT1的降解,导致微管乙酰化水平降低,从而抑制HPIV3复制的抗病毒机制。揭示了VIM蛋白抑制HPIV3复制的分子机制,并鉴定到一段来源于VIM蛋白的抗病毒多肽,为抗HPIV3药物研发提供了新的思路。
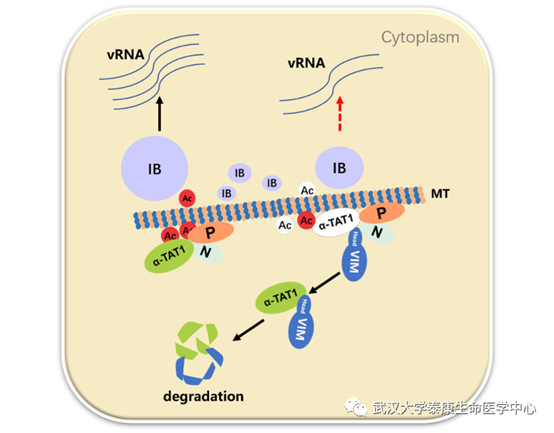
图二、VIM蛋白抑制HPIV3复制的模式图
武汉大学生命科学学院/病毒学国家重点实验室、武汉大学泰康生命医学中心陈明周教授, 武汉大学生命科学学院/病毒学国家重点实验室覃雅丽副教授为该论文共同通讯作者,博士生刘朋飞和湖北中医药大学张胜威副教授为共同第一作者。该研究得到了国家自然科学基金、国家重点研发计划等的资助。
全文链接:https://doi.org/10.1371/journal.ppat.1010856