天然的生物催化体系通常在微生物细胞这个微型工厂内会形成物理上、空间上组织有序的多酶复合体、酶分子脚手架或者反应微区,这种类似机器组装的高度组织性带来了高效的催化能力。然而,人工构建的合成体系多不存在这种高效的组织性,由此引发的目标途径合成效率低、代谢流不平衡等问题,很大程度上限制了人工合成体系的生物制造潜力。近年来,随着合成生物学的发展,通过利用对接元件在空间上建立多酶组装体系,能够便捷有效地改善上述问题。
2022年9月22日,武汉大学药学院/组合生物合成与新药发现教育部重点实验室、武汉大学泰康生命医学中心刘天罡教授团队在Nature Communications杂志上发表了题为“Metabolic pathway assembly using docking domains from type I cis-AT polyketide synthases”的研究论文,模拟了天然模块聚酮合酶的有序组装,开发的mPKSeal策略能够有效提高人工细胞工厂的合成效率。

该研究针对天然模块聚酮合酶 (PKS)中研究较多的I型cis-AT聚酮合酶,利用其结构中的对接域,模拟其高度有序的组装方式,开发了“mimic PKS enzyme assembly line (mPKSeal)”多酶组装策略(图1)。
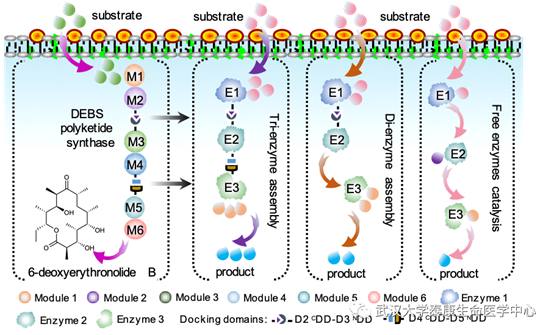
图 1. mPKSeal多酶组装策略(以红霉素聚酮合酶DEBS为例)
在本研究中,作者将源于红霉素聚酮合酶DEBS的mDEBSeal策略用于虾青素代谢途径酶的组装,虾青素的产量最高提高了2.4倍 (产量达16.9 mg/g DCW)。除了DEBS,目前自然界中已经被鉴定的I型cis-AT PKS超过1600种,这些多样的PKS系统含有多样的对接域。作者进一步发现来源于不同PKS的mAURSeal、mFKBSeal及mRAPSeal策略同样可以提升虾青素的产量。同时,作者将不同PKS来源的对接域进一步划分为不同类别:H1a–T1a, H1b–T1b,H2–T2等,发现同一分类下的对接域仍然能够有序组装,并实现虾青素产量的提升。虾青素是迄今为止自然界中发现的最强的抗氧化剂,具有抑制肿瘤发生,增强免疫力,清除体内自由基等多方面的生理作用,在保健品、医药、化妆品、食品添加剂以及水产养殖等方面具有广阔的应用前景,本研究为其高效合成提供了一种新策略。
这是该研究团队继RIAD/RIDD双酶组装策略之后的又一多酶组装策略的开发,前者已在不同报道中显示出其良好的应用潜力,而mPKSeal策略不再局限于两种酶的组装,而是可拓展为同一体系中的多种酶有序组装,且潜在的组装元件个数超万,不仅为生物源药物的高效合成提供了一种新策略,也有望突破现有组装元件的个数,并改善同一体系中组装不同对象数量上的限制,为更广泛的应用场景提供工具和策略选择,为生物催化、代谢工程及合成生物学等相关领域提供更广泛有效的提高合成效率的解决方案。
武汉大学药学院/组合生物合成与新药发现教育部重点实验室、武汉大学泰康生命医学中心刘天罡教授、邓子新教授、中科院深圳先进技术研究院马田副研究员为共同通讯作者。该研究工作得到国家重点研发计划、国家自然科学基金等支持。
全文链接:https://doi.org/10.1038/s41467-022-33272-2