2022年11月底,武汉大学药学院、泰康生命医学中心教授高帅和原普林斯顿大学教授颜宁共同在Cell(11月22日),Nature Communications(11月30日)杂志在线发表电压门控钙离子通道结构机制的最新研究成果。



Cell论文题为“Structural basis for the severe adverse interaction of sofosbuvir and amiodarone on L-type Cav channels”。索非布韦作为靶向丙肝病毒NS5B聚合酶的药物使得丙肝的治愈率达到近乎百分百,胺碘酮为抗心律失常药物主要通过抑制心脏的离子通道发挥作用。索非布韦与胺碘酮联合用药后,发现患者出现严重的心律过缓现象,甚至导致病人死亡。该论文通过高分辨冷冻电镜、细胞实验、分子对接等研究方案,解释了丙肝“神药”索非布韦与抗心律失常药物胺碘酮联合使用引发严重副作用的分子机制,为开发更加安全的丙肝药物奠定了结构基础,为药物副作用研究提供了新的思路。
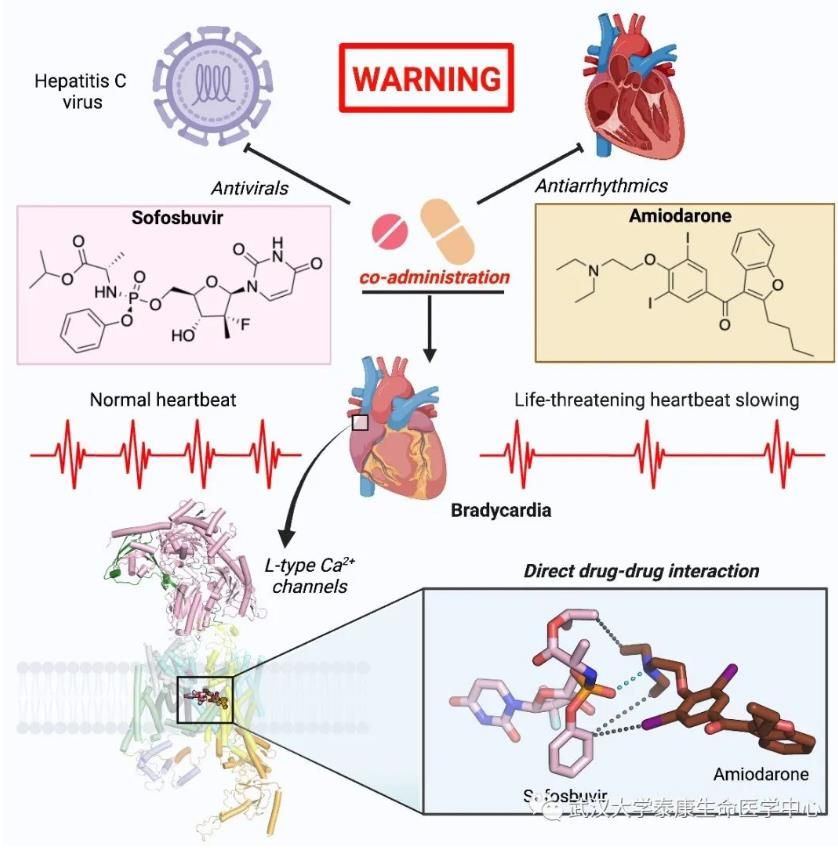
图表 1胺碘酮与索非布韦类似物作用模式图
Nature Communications论文题为“Structures of the R-type human Cav2.3 channel reveal conformational crosstalk of the intracellular segments”。R型电压门控钙离子通道Cav2.3在神经元与神经内分泌细胞中广泛表达,是治疗疼痛、癫痫、帕金森等疾病的潜在药物靶点。通过高分辨冷冻电镜、质谱、突变电生理等实验,解析了首个R型钙离子通道Cav2.3的结构,第二个电压感受结构域处于向下的构象,本论文重点研究了Cav2.3特殊的结构域CH2II的关键作用模式,通过收紧通道蛋白细胞胞内侧的近膜区域来稳定通道的失活构象,将其删除后通道的胞内区域变得更加灵活,导致在结构中几乎看不到。
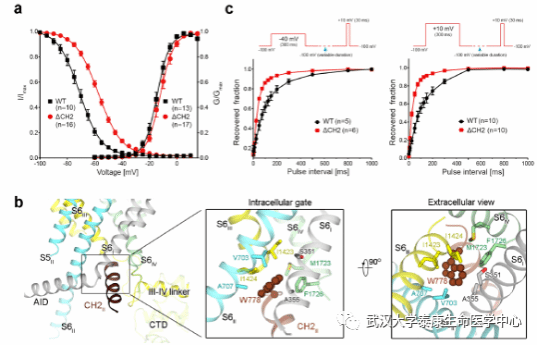
图表 2 CH2II结构域稳定了Cav2.3通道的失活状态
这是继2021年7月《Nature》杂志发表镇痛药物齐考诺肽调控Cav2.2分子机制、2022年4月《Cell Research》杂志发表抗晕动症药物桂利嗪抑制Cav1.3分子机制以来,高帅教授在该领域的又一重大突破。高帅教授系统性的研究了钙离子通道的分子机制及多种靶向药物的不同调节模式,为创新性药物的研发奠定了重要的结构基础。
武汉大学药学院、泰康医学中心高帅教授、前普林斯顿大学颜宁教授为这两篇文章共同通讯作者。普林斯顿大学博士后姚霞,武汉大学药学院高帅为《Cell》杂志为共同第一作者,普林斯顿大学博士后姚霞为《Nature Communications》杂志第一作者。
全文链接:1. https://www.cell.com/cell/fulltext/S0092-8674(22)01370-82. https://www.nature.com/articles/s41467-022-35026-6