2022年12月7日(当地时间),病毒学国家重点实验室/生命科学学院、泰康生命医学中心严欢课题组在Nature 以长文 (Article) 形式在线发表了研究论文“Close relatives of MERS-CoV in bats use ACE2 as their functional receptors”(MERS冠状病毒在蝙蝠中的近亲病毒使用ACE2作为它们的功能性受体)。

 NeoCoV于2012年在南非的开普棕蝠(Cape serotine)样本中被发现,是目前自然界已发现的最接近中东呼吸综合征病毒(MERS-CoV)的一种冠状病毒。严欢课题组在探索多种代表性蝙蝠冠状病毒功能性受体的过程中,发现NeoCoV和PDF-2180这两种MERS相关冠状病毒的假病毒能够以较低效率进入外源表达人ACE2受体的细胞。而领域内的人已经熟知,ACE2(angiotensin-converting enzyme 2)是新冠病毒SARS-CoV-2等Sarbecovirus亚属冠状病毒的受体。这一出乎预料的结果引起了研究组的高度重视。研究人员利用假病毒系统,进一步测试了46种蝙蝠ACE2受体,发现这两种病毒可以更加高效地结合多种阳翼手目蝙蝠的ACE2受体进入细胞。这一结果突破了目前人们对冠状病毒受体的传统认知,首次揭示了MERS相关冠状病毒可以使用ACE2而非DPP4(dipeptidyl peptidase 4,MERS-CoV等Merbecovirus亚属冠状病毒的受体)进入细胞。
NeoCoV于2012年在南非的开普棕蝠(Cape serotine)样本中被发现,是目前自然界已发现的最接近中东呼吸综合征病毒(MERS-CoV)的一种冠状病毒。严欢课题组在探索多种代表性蝙蝠冠状病毒功能性受体的过程中,发现NeoCoV和PDF-2180这两种MERS相关冠状病毒的假病毒能够以较低效率进入外源表达人ACE2受体的细胞。而领域内的人已经熟知,ACE2(angiotensin-converting enzyme 2)是新冠病毒SARS-CoV-2等Sarbecovirus亚属冠状病毒的受体。这一出乎预料的结果引起了研究组的高度重视。研究人员利用假病毒系统,进一步测试了46种蝙蝠ACE2受体,发现这两种病毒可以更加高效地结合多种阳翼手目蝙蝠的ACE2受体进入细胞。这一结果突破了目前人们对冠状病毒受体的传统认知,首次揭示了MERS相关冠状病毒可以使用ACE2而非DPP4(dipeptidyl peptidase 4,MERS-CoV等Merbecovirus亚属冠状病毒的受体)进入细胞。
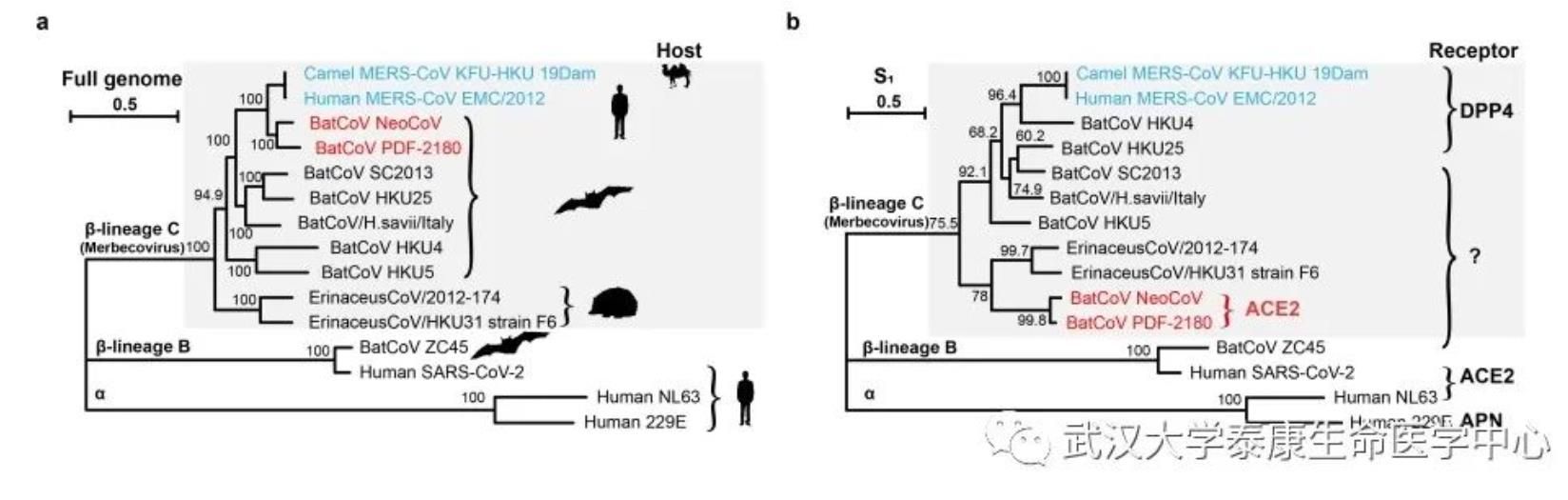
图1. 部分代表性冠状病毒的亲缘关系、自然宿主以及受体使用情况
在此基础上,中科院生物物理所王祥喜团队通过冷冻电镜技术成功解析了伏翼蝠(Pipistrellus pipistrellus)ACE2与这两种病毒刺突蛋白受体结合结构域(RBD)复合物的高分辨率结构,美国华盛顿大学David Veesler团队也通过冷冻电镜技术解析了PDF-2180刺突蛋白全长三聚体的高分辨率结构。结构分析显示,有别于SARS-CoV、SARS-CoV-2和NL63三种同样使用ACE2受体的人类冠状病毒,NeoCoV和PDF-2180使用一种依赖于蛋白-糖基相互作用的全新结合模式识别ACE2。此外,NeoCoV和PDF-2180的RBD在ACE2上的结合印迹(footprint)相对于其它三种病毒也显著不同,这提示在进化历程中,亲缘关系较远的冠状病毒曾趋同进化独立地选择并适应ACE2为受体。
之后,研究人员进一步合作探索了这两种病毒识别受体的分子机制及相关抗体阻断假病毒进入细胞的能力。序列分析与突变研究发现,人ACE2的RBD结合印迹上338-342位氨基酸相对于伏翼蝠ACE2的序列差异是导致其介导感染能力较差的关键原因,但NeoCoV可通过其刺突蛋白上T510F的单点突变实现对人ACE2的高效识别。抗体中和实验显示,新冠疫苗接种者的血清和靶向MERS-CoV RBD的单克隆抗体在目前的实验条件下均无法抑制NeoCoV和PDF-2180假病毒的感染,而靶向ACE2的特异性抗体(H11B11)以及两种针对β属冠状病毒的广谱中和抗体(B6和S2P6)可以有效地阻断这两种病毒的假病毒进入细胞。
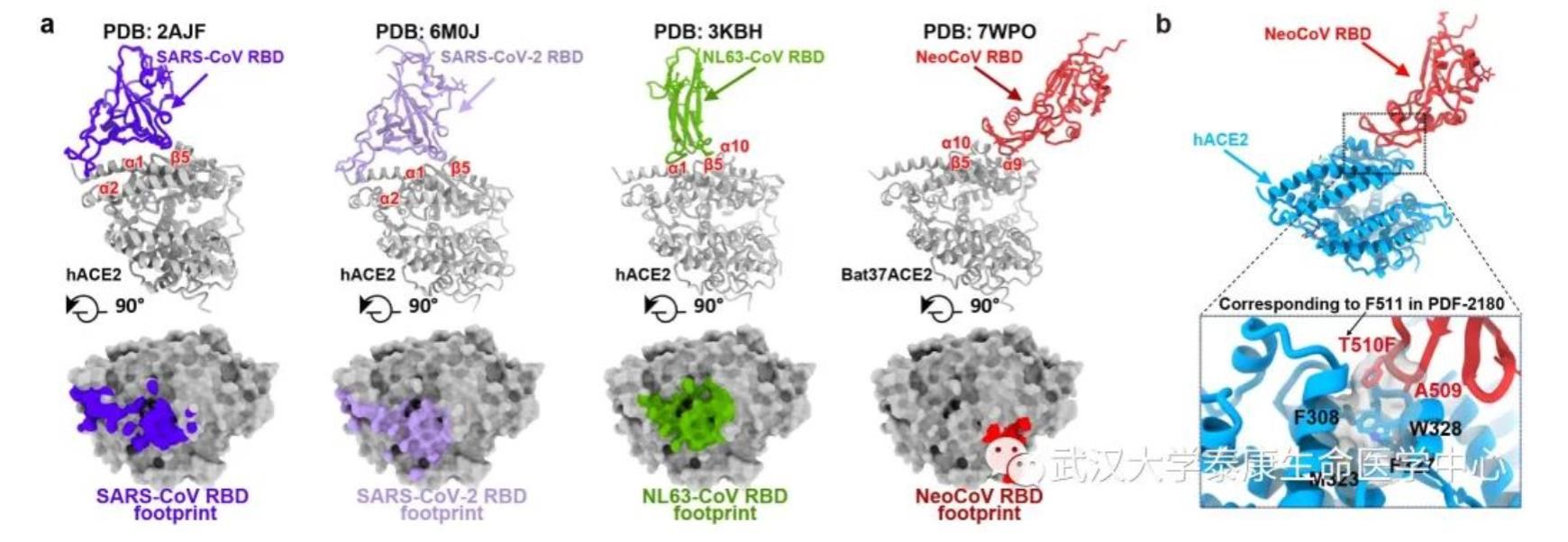
图2. 不同冠状病毒RBD及其结合ACE2的模式(a)和携带T510F突变的NeoCoV RBD与人ACE2的相互作用(b)
综上,该研究揭示了两种蝙蝠MERS相关冠状病毒(NeoCoV和PDF-2180)的功能性受体为ACE2,解析了这两种病毒与受体结合的复合体以及PDF-2180刺突蛋白三聚体的结构,提示了这一类病毒对人类健康的潜在威胁,并为MERS-CoV的蝙蝠起源假说提供了新的支持证据。该研究成果有助于进一步促进针对使用ACE2受体的MERS相关冠状病毒的基础研究,并为相关疫苗与抗病毒药物的研发奠定基础。最后需要说明的是,该研究涉及的所有感染实验均使用低风险的假病毒,并未涉及冠状病毒真病毒以及对真病毒进行遗传改造。
武汉大学病毒学国家重点实验室/生命科学学院、泰康生命医学中心严欢研究员,中科院生物物理所王祥喜研究员和美国华盛顿大学生物化学系David Veesler教授为该论文的共同通讯作者;武汉大学生命科学学院博士生熊清、硕士研究生马成鲍、中科院生物物理所曹磊副研究员和美国华盛顿大学生物化学系M. Alejandra Tortorici博士为该论文的共同第一作者。该研究得到国家自然科学基金、武汉大学新冠肺炎研究专项基金、中国科学院战略重点研究项目、国家重点研发计划项目等资助。
全文链接:https://www.nature.com/articles/s41586-022-05513-3