2023年8月3日,武汉大学公共卫生学院/泰康生命医学中心缪小平教授,公共卫生学院田剑波教授团队,在Gastroenterology(IF: 29)在线发表了题为:Genetic control of alternative splicing and its distinct role in colorectal cancer mechanisms的研究论文。

目前全基因组关联研究(Genome-wide association study, GWAS)已经发现了大量与包括肿瘤在内的多种复杂疾病风险相关的易感位点。然而,这些遗传位点影响疾病的机制仍不清楚,这使得目前疾病易感基因的鉴定及治疗靶点的发掘困难重重。这些疾病相关的遗传位点大都位于非编码区域,表明它们可能是通过调控基因表达(Expression quantitative trait locus,eQTL)来介导疾病发生,然而,研究发现eQTLs只能解释一小部分疾病遗传度,除基因表达以外,其他分子机制也可能发挥重要作用。大量证据表明,前体mRNA剪接过程受到基因组遗传位点密切调控,这些遗传位点被称为剪接数量性状位点(Splicing quantitative trait locus, sQTL),可导致个体间可变剪接的差异,从而影响疾病风险。然而,目前仍然缺乏对sQTLs的功能特征注释,以及对疾病遗传度的解释和预防医学的转化应用。
为解决上述问题,研究者首先对33种癌症类型中的sQTLs进行系统注释,表征了sQTLs及其剪接基因的功能特性。发现sQTLs显著富集于肿瘤易感区域,且独立于eQTLs解释肿瘤的遗传归因度。研究者进一步利用154对中国人群的结直肠癌肿瘤和正常组织中系统构建了sQTLs图谱,结合中国人群结直肠癌GWAS数据(4293例病例及 7176例对照)构建了第一个中国人群的结直肠癌sQTLs遗传图谱,并在欧洲人群中进行独立的验证(17789例病例及 19951例对照)。值得注意的是,研究者利用鉴定的一批sQTLs位点构建了功能性多基因风险评分(Polygenetic risk score, PRS),相比传统的GWAS风险位点,能更有效地提高结直肠癌风险分层效能;观察到携带遗传风险评分越高的个体罹患肿瘤的风险越高,相比较携带低遗传风险评分的个体,携带高遗传风险评分的个体罹患结直肠癌的风险增加了1.62倍,提示sQTLs不仅在剖析肿瘤遗传易感新机制方面发挥重要作用,还有望应用于肿瘤高危人群识别和早筛方案构建。
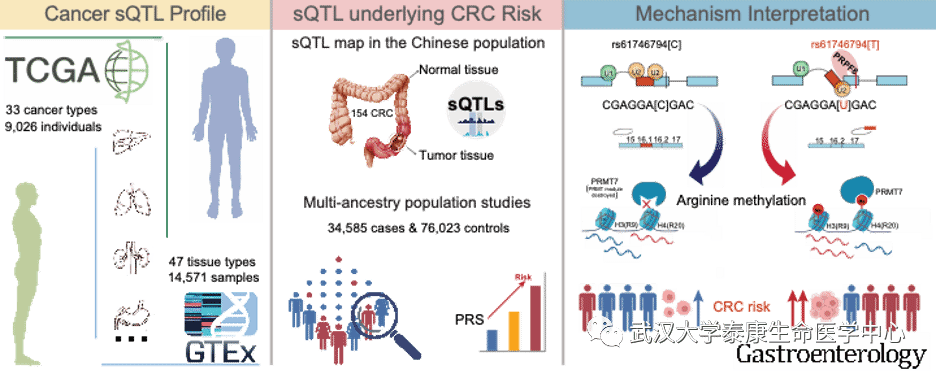
最后,研究者对人群关联最显著的可变剪接位点rs61746794进行大规模、多中心的人群流行病学(34585例病例和76023例健康对照)和分子生物学机制深入解读,发现 rs61746794-T显著增加中国人群和欧洲人群罹患结直肠癌的风险。进一步的机制实验发现rs61746794可导致PRMT7基因 16号外显子的异常剪接,这个过程受到剪接因子 PRPF8的精细调控。相比于PRMT7-V1,PRMT7-V2转录本具有更高的精氨酸甲基化(H3R2me2s 与 H4R3me2s)修饰能力,异常激活下游YAP、AKT、KRAS等一系列经典致癌通路,进而促进结直肠癌发生。总之,该研究提供了迄今为止最全面的肿瘤sQTLs图谱及中国人群的结直肠癌sQTLs遗传图谱,揭示了sQTLs在肿瘤发生发展中独立而重要的作用,为解析人类复杂疾病的遗传易感机制提供了新方向,并可作为肿瘤高危人群精准识别的潜在分子标志物。
原文链接:https://www.sciencedirect.com/science/article/pii/S0016508523048394?via%3Dihub