近日,武汉大学公共卫生学院、泰康生命医学中心缪小平教授,公共卫生学院田剑波教授团队,在Nature子刊Nature Communications (IF:16)在线发表了题为 “Genome-wide enhancer-gene regulatory maps link causal variants to target genes underlying human cancer risk” 研究论文。

目前,全基因组关联研究(Genome-wide association study, GWAS)已经鉴定出数千个与肿瘤等多种复杂疾病风险相关的易感位点,为疾病研究提供了宝贵的遗传信息。在GWAS所发现的易感位点中,超过90%的位于基因组非编码区,其统计学关联背后的生物学机制尚有待研究。在基因组高通量检测技术的支持下,研究者发现这些非编码区域中包含着许多顺式调控元件(Cis-Regulatory Element,CRE),比如启动子、增强子、绝缘子等,可在基因表达调控中发挥巨大的作用,位于调控区域的遗传变异可通过影响与转录因子的结合能力,影响CRE的活性以及染色质空间交互作用,从而改变靶基因的表达水平,进而影响疾病风险。因此,如何发现真正的“致病”遗传位点(Causal variants)并揭示其生物学功能,是目前肿瘤基因组流行病学研究的重要机遇和挑战,也是将其应用于预防医学实践,成为潜在的生物标志物和预防靶点的关键。然而,高通量地解析对非编码元件的功能是极为困难的,需要从众多转录调控序列中鉴定出真正具有功能的增强子,并识别其真正调控的目标基因。因此,亟需开发一种高通量方法可以系统性地识别和鉴定非编码区域遗传位点的生物学功能及其直接作用的目标基因,尤其是针对中国人群结直肠癌演变过程中特异性的功能性调控元件。
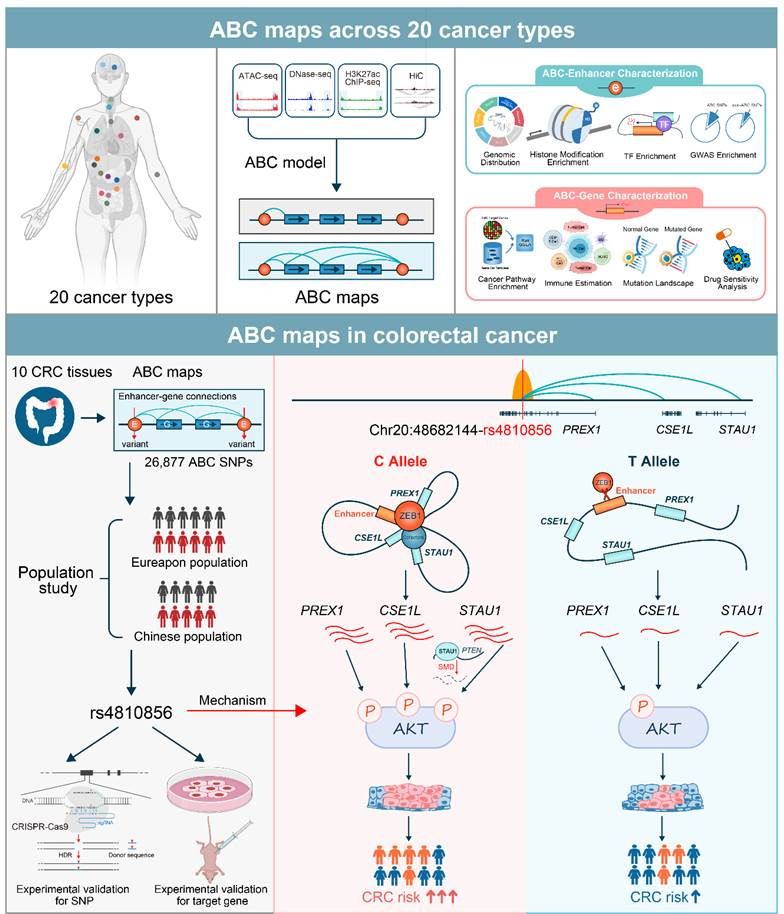
为解决上述问题,研究者采用Activity-by-Contact (ABC) 模型,在全基因组范围内绘制增强子-目标基因映射图谱。该模型设计的基本原理是:候选调控元件对目标基因表达的定量影响应该取决于它作为增强子的活性(Activity),加权于它与目标基因启动子的染色质接触频率(Contact);而一个候选调控元件对目标基因表达的相对贡献值取决于该元件的定量影响除以目标基因所在区域内所有候选调控元件的总定量影响。ABC模型系统整合了代表调控元件活性状态的ATAC-seq和H3K27ac ChIP-seq信号峰,以及代表染色质接触频率的Hi-C数据,有效地在全基因组范围内鉴定活性增强子元件及其调控的靶基因,进而构建增强子-靶基因精准映射图谱,并且有助于解释调控型遗传变异的生物学功能。研究者基于此模型,通过智能整合ATAC-seq、ChIP-seq、Hi-C和RNA-seq等多维度生物组学数据,系统地构建了涵盖20种人类癌症类型的全基因组增强子-目标基因映射图谱。研究者共鉴定出了544,849个增强子-目标基因调控映射对,涉及266,956个增强子元件和216,268个目标基因,平均每个肿瘤类型27,243个增强子-目标基因调控映射对,最少是子宫体内膜癌20,134个,最多是急性髓系白血病37,053个,为系统构建人类恶性肿瘤表观遗传调控图谱提供了丰富的遗传资源和计算框架。
此外,研究者利用一系列功能注释方法详细表征了ABC增强子及其调控的目标基因的功能特征,。结果显示:ABC增强子遗传位点显著富集在染色质活性区域和肿瘤的易感GWAS区域,提示这些遗传位点对解析疾病的遗传易感性有一定的贡献。同时也发现ABC增强子调控的目标基因则具有一定的肿瘤分子特征,与多个肿瘤细胞信号通路、突变负荷和肿瘤免疫微环境密切相关,提示ABC调控的目标基因具备一定临床转化价值和药物靶标潜力。值得一提的是,相较于其他方法,如基于遗传位点位置分布、eQTL统计学数量关系、增强子活性与基因表达相关性以及染色质交互频率,ABC模型在有效鉴定功能性调控位点及其目标基因方面具有更高的可重复性和准确性,这可能是因为ABC模型从基因组功能学角度出发,综合考虑了增强子表观活性以及染色质远程交互作用之间的协作对基因表达调控的影响,因而展现出更强的预测效能。
进一步地,研究者利用该模型系统绘制出中国人群结直肠癌的增强子-目标基因映射图谱,高通量鉴定出超过34,130个增强子-基因调控对,涉及15,121个增强子元件和12,351个目标基因。随后,研究者通过大规模、多中心的人群流行病学研究:首先在包括17,789例病例和19,951例对照的大规模人群中,系统地筛选了与结直肠癌人群易感性显著相关的ABC调控遗传变异;并在包括6,024例病例和10,022例健康对照的大规模中国人群中进行独立验证。结果发现ABC评分最高的调控遗传位点rs4810856和结直肠癌人群易感性显著相关(OR=1.11, 95%CI=1.05-1.16,P=4.02×10−5),并通过ABC预测到三个潜在的目标基因PREX1、CSE1L和STAU1。最后通过一系列体内外生物学实验,发现rs4810856 T>C变异通过转录因子ZEB1介导的染色质远程交互作用,同时远程激活了PREX1、CSE1L和STAU1的表达,三个目标基因协同异常激活p-AKT信号通路,促进结直肠癌细胞的增殖能力和裸鼠皮下成瘤能力,增加个体罹患结直肠癌的风险。总之,该研究在全基因组范围内系统绘制了目前为止人类肿瘤最全的增强子调控元件-目标基因遗传调控映射图谱,为全面解析癌症的遗传复杂病因和易感新机制提供了新的理论线索和分析框架,发现的功能遗传标志物可为肿瘤高危人群识别和个体化精准防治提供有效工具,具有潜在的早期筛查和临床应用转化价值。